В развитии опухоли рассматривают 3 этапа: инициация (мутация); промоция; прогрессия.
Инициация – под влиянием канцерогенов \ митогенов наступает мутация клеток.
Защита от мутации – апоптоз; репарация ДНК; ЕК-клетки.
Мутация – причина развития опухоли. Мутация – постоянный процесс, но не всегда мутировавшая клетка превращается в опухоль.
Промоция – непременное условие реализации опухоли, т.е. развитие из одной мутировавшей клетки целого клона клеток, образующего ткань опухоли.
Промоторы опухолевого роста должны воздействовать на мутировавшую клетку непрерывно в течение длительного времени. Если действие промоторов прекращается до приобретения клеткой злокачественного фенотипа, то клетка может восстановить чувствительность к регуляторным влияниям организма. Таким образом, промоторы – это вещества, способствующие ускользанию мутантной клетки от регуляторного воздействия организма.
Прогрессия – злокачественный рост, характеризующийся формированием опухолью собственной сосудистой сети, прорастанием в органы и ткани, расселением опухолевых клеток по организму за пределы первичного очага (метастазирование), взаимовлияние обменных процессов опухоли и организма и развитие различных неопластических синдромов, т.е. токсико-метаболических проявлений опухолевого роста.
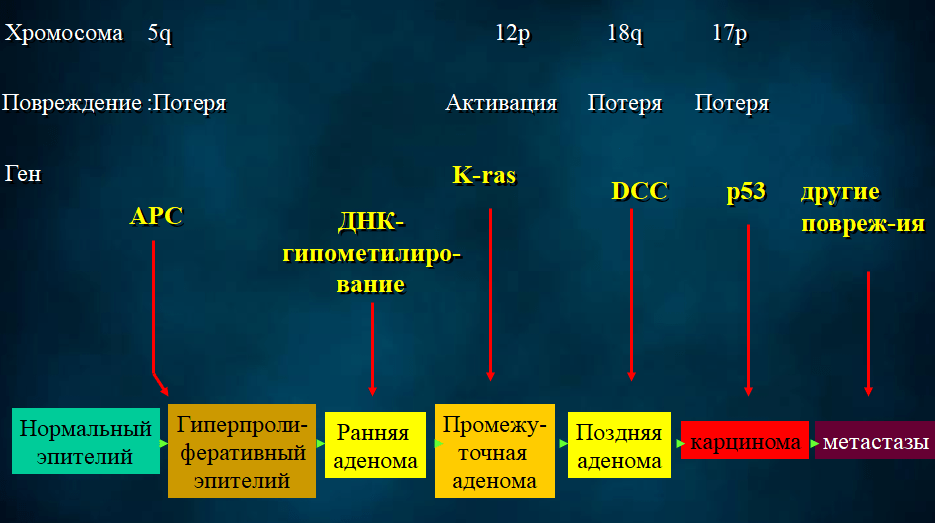
Модель последовательных генетических изменений, приводящих к метастатическому раку кишечника
Опухоль формируется и растет под влиянием противоположно направленных, но не взаимоисключающих иммунных реакций. Динамика опухолевого роста определяется равновесием между факторами иммунного надзора с одной стороны и пробластомными факторами, способствующими росту опухоли, с другой.
Антибластомные иммунные факторы:
- Клеточные
- Т-лимфоциты киллеры
- ЕК- и К-клетки
- активированные макрофаги
2. Гуморальные
- специфические антитела
- интерлейкин 1
- интерлейкин 2
- фактор некроза опухолей (ФНО)
- интерфероны
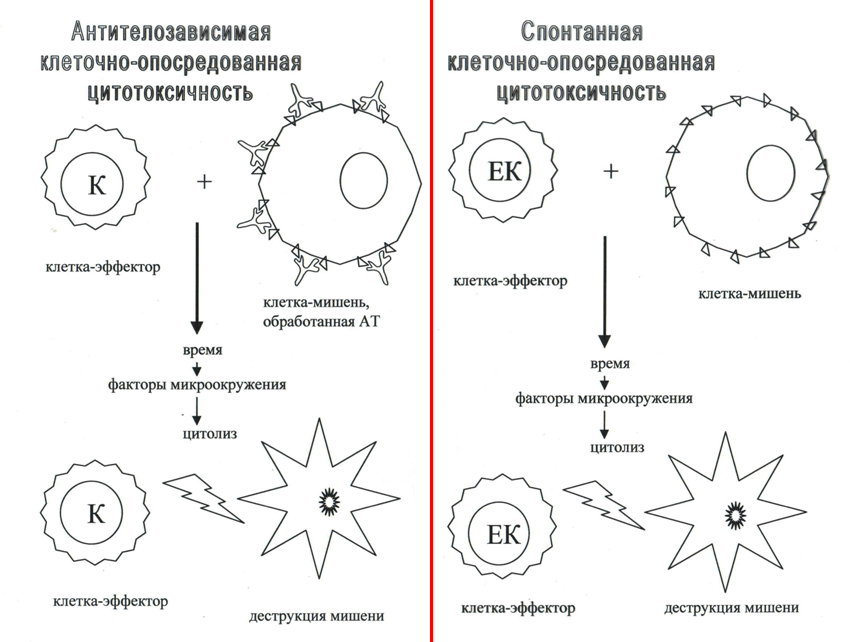
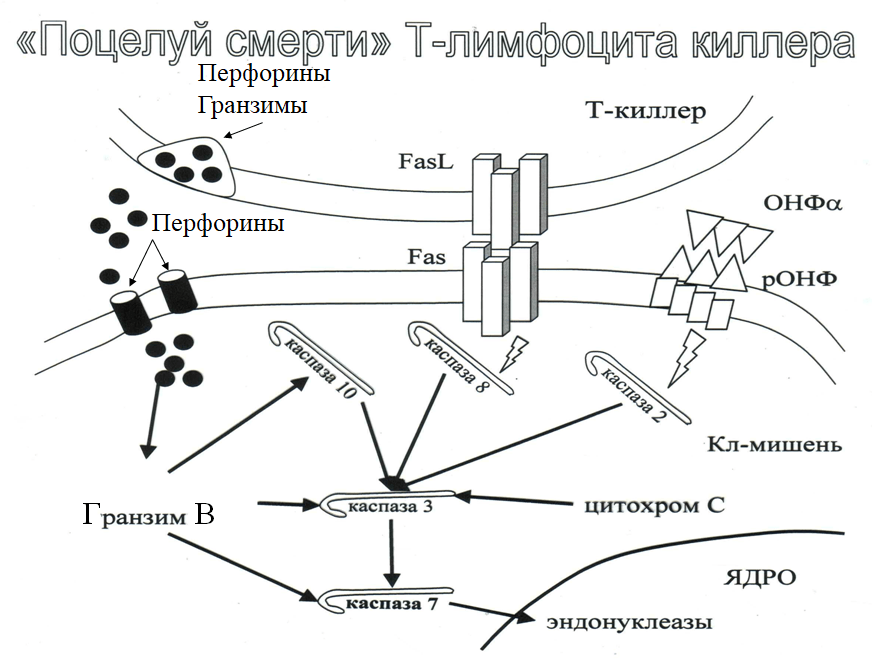
Факторы иммунорезистентности опухоли
- Слабая иммуногенность опухолевых антигенов
- Постоянная модификация антигенов
- Селекция иммунологически устойчивых клеток
- Потеря экспрессии HLA антигенов класса I
- Выделение растворимых опухолевых антигенов
- Экспрессия на поверхности опухолевых клеток рецепторов к различным ростовым факторам
- Приобретение резистентности к апоптозу: потеря рецептора к ФНО, появление на мембране FasL
- Продукция опухолевыми клетками ИЛ-6; ИЛ-10; ФНО
Пробластомные факторы, подавляющие иммунитет
- Супрессивные вещества, продуцируемые лимфоцитами и макрофагами
- Блокирующие антитела
- Циркулирующие иммунные комплексы
- Простагландины ПГЕ 2
- Интерлейкин 10
- Трансформирующий фактор роста бета (TGF beta):
- подавляет продукцию цитокинов (ИЛ-12),
- подавляет созревание Т-киллеров,
- подавляет экспрессию рецепторов к цитокинам
Пробластомные факторы, усиливающие рост опухоли
- Фактор роста опухоли, продуцируемый макрофагами
- Интерлейкин 2
- Интерлейкин 6
- Фактор роста сосудистого эндотелия
- Иммунодефицитное состояние:
- нарушение созревания Т-киллеров,
- нарушение функции антиген-презентирующих клеток
Функциональная классификация карцинома-ассоциированных генов


Опухоль-специфические антигены
- потеря контактной ингибиции
- увеличение скорости пролиферации
- изменение антигенного профиля
Опухоль-специфические антигены, выявляемые у всех больных с данной опухолью

Опухоль-эмбриональные антигены

Основные факторы, влияющие на состояние иммунитета у онкобольных:
- стресс
- химиотерапия
- операционная травма
- лучевая терапия
- наркоз
- степень нарушения питания
- возраст
- степень радикального удаления опухоли
Особенности иммунотерапевтических подходов у больных с онкопатологией
Применение иммунотерапевтических мероприятий при лечении больных с онкопатологией делится на два принципиально разных подхода:
- Воздействие на иммунную систему больного с цельюиммунореабилитации.
- Воздействие на опухоль с целью иммунотерапии.
Реализация плана иммунореабилитации
До операции:
- иммуномониторинг – определение иммунного статуса;
- наличие специфического опухолевого антигена;
- назначение иммуномодуляторов широкого спектра (при необходимости)
После операции и химио-радио-терапии:
- иммуно-мониторинг (идеально: ИЛ-10, ИЛ-6);
- детоксикация (энтеросорбция, плазмаферез);
- назначения иммуномодуляторов длительными курсами с учетом иммунограмм
Собственно иммунотерапия опухолей
- Использование цитокинов:
- интерлейкин 2
- интерфероны
- комбинации цитокинов (ИЛ-2 + -ИНФ; ИЛ-2 + ИЛ-4 + ИЛ-12; ФНО + ИЛ-2; другие комбинации)
Основной недостаток – выраженные побочные эффекты, дороговизна.
2. Использование иммуноцитов:
- лимфокин-активированные (ЛАК)
- ЛАК + цитокины,
- лимфоциты, инфильтрирующие опухоль (ЛИО)
- аутолимфоцитотерапия
3. Использование цитокинов в комбинации с цитостатиками
4. Аппликационное применение:
- ЛАК с малыми дозами цитокинов
5. Введение иммунодоминантного опухолевого пептида в антиген-презентирующие клетки
6. Превращение опухолевой клетки в антиген-презентирующую с помощью трансфекции генов ИЛ-2; ИЛ-4; ИЛ-7; гамма-ИНФ и В7.1
7. Препараты на основе моноклональных антител
Эффективность иммунотерапии показана при следующих опухолях:
- меланома
- рак почки
- неходжкинская лимфома
- волосатоклеточный лейкоз
- рак прямой кишки
- рак яичника
- глиомы
- саркома мягких тканей
- рак мочевого пузыря
Основная причина неудач – наличие иммуносупрессии в организме больного.